
精彩回顾
1.大咖主题分享
目前在“限电”、“限产”背景下,绿色制药风口正旺,在国际“碳中和”的大战略下,未来5-10年制药进行绿色技术升级是发展的主旋律。
.png)

▲马大为 中国科学院院士
马大为院士对《铜/草酰二胺催化的偶联反应》这一主题,做了深度、精彩的分享。马院士针对铜催化的碳-杂原子键偶联反应,发展了氨基酸和草酰二胺两代配体,突破反应条件苛刻和普适性差的局限,得到了广泛的应用。

▲张绪穆 南方科技大学教授
2. 圆桌对话探讨
绿色化学是当前化学学科发展的主要方向,全球范围制药都倡导合成工艺和生产过程的绿色化;利用绿色合成工艺制备药物,可提高利用率,降低废弃物的产生,减轻药物合成对环境的影响。那么实现绿色制药的方式有哪些,各有什么利弊,如何相互协同?朗华制药总裁马建国博士与参与圆桌论坛的各位嘉宾一起,从各自的专业领域对上述问题做出了精彩的解答。

▲圆桌讨论:绿色技术在制药领域中的应用
【主 持】马建国 浙江朗华制药有限公司 总裁
【嘉 宾】 曾会应 兰州大学 教授
【嘉 宾】 李金亮 上海应用技术大学 教授
【嘉 宾】 陈代杰 上海交通大学药学院教授
【嘉 宾】 竺 伟 尚科生物医药(上海)有限公司 总经理
【嘉 宾】 黄勇开 宁波酶赛生物工程有限公司 董事长
毕明达博士作为朗华制药副总裁,参与了圆桌讨论“创新药研发中的坑“。毕博士曾在国际制药巨头工作多年,具有丰富创新药物研发经验。圆桌嘉宾认为唯有紧紧盯住未被满足的临床需求,找到切实解决患者痛苦的新药,才会让新药研发工作事半功倍。

▲圆桌讨论:药物选题立项及技术选择的思考
3.展会现场直击


4.关于朗华制药
浙江朗华制药有限公司,是集研发、生产、贸易一体化运作的综合性制药企业。作为创新药物发现领域的领军企业维亚生物科技控股集团的子公司, 朗华致力于为全球合作伙伴提供小分子药物从原料药(APIs)到制剂,从临床前到商业化供应,覆盖药物全生命周期的高效、灵活、高质量的CDMO一站式解决方案。拥有上海、台州和宁波三个研发中心,高层次研发人才200多名,领军人物均是曾在跨国制药企业工作多年的海归博士,具有丰富的创新药原料药和制剂的工艺研发、放大生产和申报经验。
浙江朗华制药有限公司建立了完善的质量管理体系和EHS管理体系,先后通过了NMPA,FDA,EDQM, PMDA, ANVISA, WHO 等国内外监管机构的GMP审计,以及PSCI审计,为全球新药研发机构和跨国制药公司长期提供优质的产品和服务,深度参与了20多个新药的上市过程,产品线涵盖肿瘤、艾滋病、糖尿病、心血管等领域,拥有良好的交付记录。
浙江朗华制药有限公司在上海、宁波、台州设有三个研发中心,拥有13000平方米的实验室和200多人的研发团队,配置有国际一流的原料药、制剂研发设备和检测仪器,包括NMR(Bruker-400 MHz)、LC-MS(Agilent)、TOF-MS (Agilent), SFC (Waters UPC2), GC-MS/MS (Waters)、GC-MS/MS (Agilent), ICP-MS, LC-CAD, XRPD、IR, UPLC 等,能够满足创新药原料药和制剂研发的全面需求。
研发中心
.jpg) |
|
.jpg) |
API和中间体生产基地 ★ 12个GMP生产车间 |
.jpg) |
★ C-NAS认证的工艺安全实验室 ★ 聚焦工艺开发 |
原料药服务
· 路线设计与筛选
· 工艺开发与优化
· 毒理批次生产
· cGMP条件下临床样品制备
· 放大及商业化生产(毫克至千吨规模)
· IND和NDA申报文件(CTD格式)撰写
制剂服务
· 晶型/盐型筛选
· 处方前研究
· 制剂处方和工艺的筛选和优化
· 制剂工艺放大和技术转移
· cGMP条件下临床样品制备(临床Ⅰ-Ⅱ期)
· IND和NDA申报文件(CTD格式)撰写
制剂平台
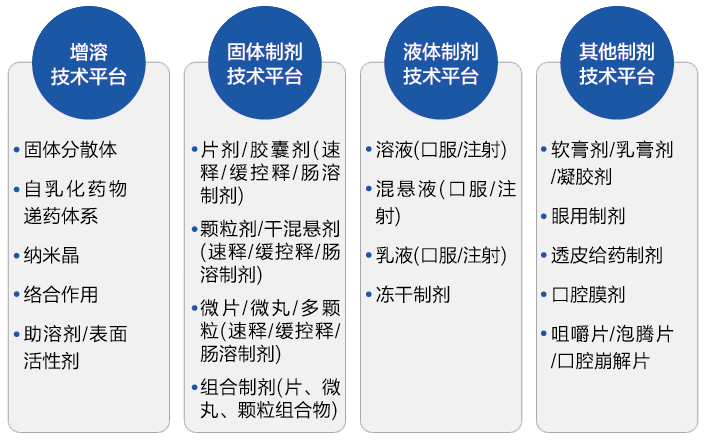
分析服务
· 原料药和制剂分析方法开发、验证、转移
· 原料药和制剂放行检测、稳定性研究
· 起始物料、中间体分析方法开发、验证、转移
· 基因毒性杂质预测和分析方法开发、验证及检测
· 元素杂质分析方法开发、验证及检测
· 微生物分析方法开发、确认
· 质量研究:杂质研究、质量标准建立
· IND和NDA申报文件(CTD格式)撰写
联系我们
CONTACT US
浙江朗华制药有限公司
ZHEJIANG LANGHUA PHARMACEUTICAL CO.,LTD.
联系方式:
邮箱: sales@langhuapharma.com
网址: http://www.langhuapharma.com